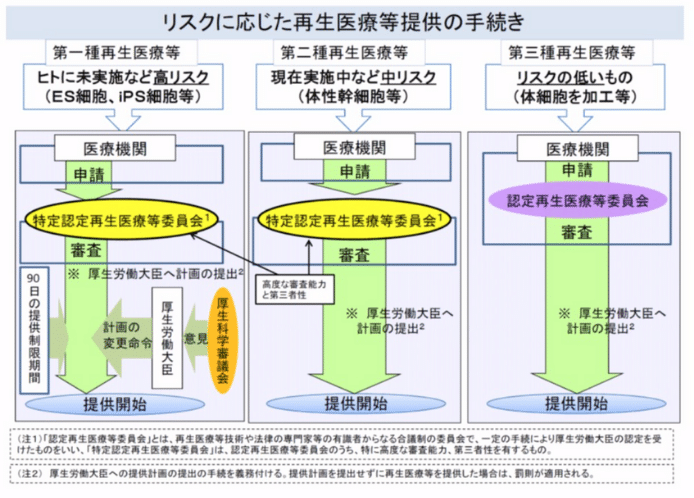
「再生医療等の安全性の確保等に関する法律」による3つの分類
ヒト由来の組織などを用いて、傷病で機能不全になった組織・臓器を再生する「再生医療」の研究は日々進んでおり徐々に実用化も始まっています。
しかし未知の医療技術ゆえに、リスクが不明な部分もあり、国は2013年に「再生医療等の安全性の確保等に関する法律」を制定するなどし「迅速な提供」と「安全性の確保」との両立を目指しています。
(平成25年11月27日公布。平成26年11月25日施行)
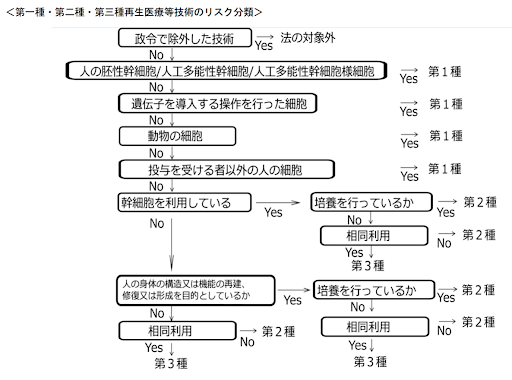
具体的には、リスクの程度に応じて再生医療技術を3つに分類し、それぞれについて提供に係る手続きを定めています(関係する厚労省令はこちら)。
厚労省ガイドラインから一部抜粋
再生医療のリスク分類
- ▼第一種再生医療等(ヒトに未実施であるなど「高リスク」の技術)
- ▼第二種再生医療等(現在実施中であるなど「中リスク」の技術)
- ▼第三種再生医療等(リスクの低い技術)
第一種再生医療等技術
▽人の胚性幹細胞、人工多能性幹細胞(iPS細胞など)または人工多能性幹細胞様細胞(皮膚の線維芽細胞からiPS細胞を経ずに直接作製された神経幹細胞など)に培養その他の加工を施したものを用いる医療技術
▽遺伝子を導入する操作を行った細胞または当該細胞に培養その他の加工を施したものを用いる医療技術(悪性腫瘍に対するリンパ球活性化療法のうちリン パ球に遺伝子を導入するような技術など)
▽動物の細胞に培養その他の加工を施したものを用いる医療技術
▽投与を受ける者以外の人の細胞に培養その他の加工を施したものを用いる医療技術
第二種再生医療等技術
▽培養した幹細胞(造血幹細胞、 神経幹細胞、間葉系幹細胞といったヒト体性幹細胞)または当該細胞に培養その他の加工を施したものを用いる医療技術
▽培養した細胞または当該細胞に培養その他の加工を施したものを用いる医療技術のうち人の身体の構造または機能の再建、修復または形成を目的とする医療技術
▽細胞の相同利用ではない医療技術(腹部から脂肪細胞を採取し、当該細胞から脂肪組織由来幹細胞を分離して、乳がんの術後の患部に乳房再建目的で投与する技術など)
第三種再生医療等技術
活性化リンパ球を用いた従来の各種がん治療など
再生医療のリスクに応じた手続き
第一種再生医療等を実施する場合には、提供計画を厚生労働大臣に届け出る(特定認定再生医療等委員会の意見を聴くことが必要)ことが義務付けられており、また90日間の提供制限期間が設けられており、その期間内に厚生労働大臣が厚生科学審議会の意見を聴いて安全性等について確認することになっています。
もし安全性などの基準に適合していないときには、厚生労働大臣から「計画の変更」に関する命令が下されます。
厚労省ガイドラインから一部抜粋
計画番号が重要
計画の審査を受け計画番号を付与された医療機関のみが再生医療を行うことができます。 計画を未提出で行なった医療機関は、法違反となります(緊急命令、改善命令等、立入検 査、罰則の対象となる)。